أجهزة طبية
تلعب إمكانية التتبع دورًا رئيسيًا في مراقبة الجودة الشاملة للأجهزة الطبية والأجهزة المختبرية والإشراف عليها وتحسينها.
لوائح الاتحاد الأوروبي
في عام 2017 لائحة الأجهزة الطبية (MDR) تم نشره وشكل بداية رحلة انتقال مدتها أربع سنوات من MDD إلى AIMDD. اعتبارًا من 26 مايو 2021 ، سيتم تطبيق MDR بالكامل. يؤثر MDR على صناعات تصنيع أو توزيع أو شراء الأجهزة الطبية.
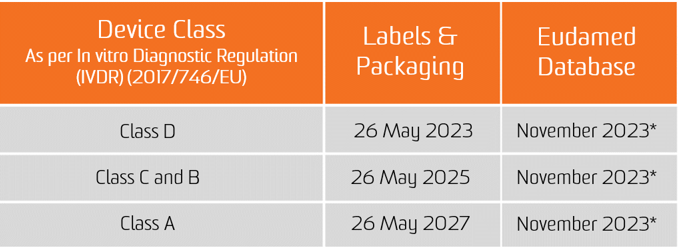
ال لائحة التشخيص في المختبر (IVDR) دخلت حيز التنفيذ في 25 مايو 2017. اعتبارًا من 26 مايو 2022 ، يجب أن تفي الأجهزة الجديدة بمتطلبات IVDR حتى يتم طرحها في السوق الأوروبية. قد يتم طرح المنتجات التي تم اعتمادها بالفعل من قبل هيئة مُبلغة في السوق حتى 25 مايو 2024 في ظل بعض الظروف وإذا كانت الشركة المصنعة تفي بالمتطلبات الأساسية المحددة المرسومة في IVDR.
ما هو UDI؟
UDI (فريد تعريف الجهاز)
ال UDI عبارة عن سلسلة من الأحرف الرقمية أو الأبجدية الرقمية التي يتم إنشاؤها من خلال معيار تعريف وتشفير مقبول عالميًا للجهاز. يسمح بتحديد لا لبس فيه لجهاز معين في السوق. يتكون UDI من UDI-DI و UDI-PI.
 UDI-DI (GS1 يعادل GTIN- رقم البند التجاري العالمي)
UDI-DI (GS1 يعادل GTIN- رقم البند التجاري العالمي)
UDI-DI هو رمز رقمي أو أبجدي رقمي فريد خاص بطراز الجهاز ويستخدم أيضًا كـ "مفتاح الوصول" إلى المعلومات المخزنة في قاعدة بيانات UDI.
 UDI- PI (GS1 Equivalent AI - معرفات التطبيق)
UDI- PI (GS1 Equivalent AI - معرفات التطبيق)
يعد UDI-PI رمزًا رقميًا أو أبجديًا رقميًا يحدد وحدة إنتاج الجهاز.
تتضمن الأنواع المختلفة من UDI-PIs الرقم التسلسلي أو رقم الدفعة أو تعريف البرنامج أو تاريخ التصنيع أو انتهاء الصلاحية أو كلا النوعين من البيانات.
تنفيذ UDI
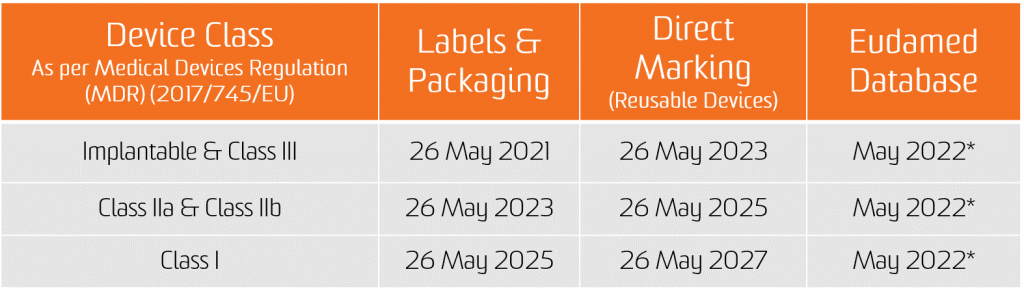
يسري الالتزام بمهمة UDI اعتبارًا من تاريخ تطبيق اللائحتين الجديدتين ، أي 26 مايو 2021 للأجهزة الطبية و 26 مايو 2022 للأجهزة الطبية التشخيصية في المختبر.
يسري الالتزام بتقديم بيانات UDI في قاعدة بيانات EUDAMED اعتبارًا من 26 نوفمبر 2022 للأجهزة الطبية و 26 نوفمبر 2023 للأجهزة الطبية التشخيصية في المختبر (بشرط أن تعمل EUDAMED بكامل طاقتها قبل تاريخ تطبيق اللائحة المعنية ؛ وإلا فإن هذا الالتزام تنطبق بعد 24 شهرًا من أن تصبح EUDAMED تعمل بكامل طاقتها).
ومع ذلك ، سيكون المصنعون في وضع يسمح لهم بالامتثال طوعًا لالتزامات التسجيل اعتبارًا من 26 مايو 2021 للأجهزة الطبية و 26 مايو 2022 للأجهزة الطبية التشخيصية المختبرية.
تجدر الإشارة إلى أنه ، شريطة أن يعمل Eudamed بكامل طاقته ، في أي وقت بعد 26 مايو 2021 للأجهزة الطبية و 26 مايو 2022 للأجهزة الطبية التشخيصية في المختبر ، التسجيل الكامل للأجهزة (المادة 29 من MDR والمادة 26 من IVDR) لا يزال شرطًا مسبقًا للتسجيل المحتمل لحادثهم الخطير ذي الصلة في Eudamed.
* يشير إصدار CAMD في 11 نوفمبر 2020 إلى أن المفوضية الأوروبية تعلن عن تأجيل إطلاق Eudamed ككل حتى مايو 2022 لأسباب قانونية. يتزامن تاريخ الإطلاق الجديد لـ Eudamed مع تاريخ تنفيذ لائحة التشخيص المختبري ، التي من المقرر أن تدخل حيز التنفيذ في 26 مايو 2022.
ما هو EUDAMED؟
قاعدة البيانات التنظيمية الأوروبية الجديدة للأجهزة الطبية
Eudamed هي بوابة إلكترونية آمنة تعمل كمستودع مركزي لتبادل المعلومات بين السلطات المختصة الوطنية والمفوضية وفقًا للوائح MDR و IVDR.
يتضمن الدور الرئيسي لـ Eudamed المسؤوليات التالية:
تسجيل Eudamed
UDI / تسجيل الأجهزة
الحصول على الشهادات وعرضها من الجهات المقبولة
توفير بيانات التحقيقات السريرية ودراسات الأداء
الإبلاغ عن اليقظة ومراقبة ما بعد السوق
أنشطة مراقبة السوق