Γενική επισκόπηση του αφθώδους πυρετού της ΕΕ
Με την Οδηγία για τα ψευδεπίγραφα φάρμακα (FMD) που δημοσιεύθηκε τον Ιούλιο του 2011, η Ευρωπαϊκός Οργανισμός Φαρμάκων (EMA) έθεσε την αρχή των προτύπων ιχνηλασιμότητας των χωρών της Ευρωπαϊκής Ένωσης.
ο Οδηγία για τα ψευδεπίγραφα φάρμακα (Οδηγία 2011/62/ΕΕ) εισάγει εναρμονισμένα ευρωπαϊκά μέτρα για την καταπολέμηση των παραποιήσεων φαρμάκων και για να διασφαλίσει ότι τα φάρμακα είναι ασφαλή και ότι τα φάρμακα που κυκλοφορούν ελέγχονται αυστηρά. Τα μέτρα περιλαμβάνουν:
- Υποχρεωτικά χαρακτηριστικά ασφαλείας – μοναδικό αναγνωριστικό και συσκευή κατά της παραβίασης – στην εξωτερική συσκευασία των φαρμάκων
- Ένα κοινό λογότυπο σε όλη την ΕΕ για τον προσδιορισμό των νόμιμων διαδικτυακών φαρμακείων
- Αυστηρότεροι κανόνες για την εισαγωγή δραστικών φαρμακευτικών συστατικών
- Ενισχυμένες απαιτήσεις τήρησης αρχείων για τους διανομείς χονδρικής
Από το 2019, όλα τα φαρμακευτικά προϊόντα πρέπει να πληρούν πλήρως τις υποχρεώσεις του αφθώδους πυρετού. Έως το 2025, οι χώρες της ΕΕ με ξεχωριστό σύστημα, όπως η Ελλάδα και η Ιταλία, πρέπει να συμμορφώνονται πλήρως με τον κανονισμό περί φαρμακευτικής παρακολούθησης και ανίχνευσης.
Απαιτήσεις σειριοποίησης
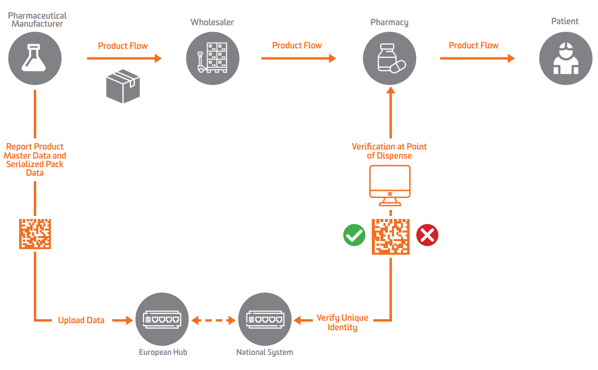
Σύμφωνα με τον αφθώδη πυρετό της ΕΕ, η σειριοποίηση πρέπει να εμφανίζεται σε επίπεδο δευτερεύουσας ή πωλήσιμης μονάδας στην Ευρώπη. Για να ενεργοποιηθεί η επαλήθευση, οι κατασκευαστές πρέπει πρώτα να σειριοποιήσουν το προϊόν και να στείλουν αυτά τα σειριακά δεδομένα σε ένα κεντρικό αποθετήριο που μπορεί να εκτελέσει ερωτήματα εναντίον του.
Για να ενεργοποιηθεί η σειριοποίηση, η επαλήθευση και η αναφορά στις Αρχές, ο αφθώδης πυρετός της ΕΕ απαιτεί από τους κατασκευαστές να επισημαίνουν πακέτα με τέσσερα στοιχεία δεδομένων που πρέπει να εκτυπωθούν σε αναγνώσιμη από τον άνθρωπο μορφή και να κωδικοποιηθούν και να αποθηκευτούν σε GS1 2D DataMatrix:
- Αναγνωριστικό προϊόντος
- Σειριακός αριθμός
- Αριθμός παρτίδας ή παρτίδας
- Ημερομηνία λήξης
Η χρήση του πέμπτου στοιχείου δεδομένων — του εθνικού αριθμού επιστροφής εξόδων — είναι προαιρετική και λίγα κράτη στην ΕΕ μπορούν να ζητήσουν να συμπεριληφθεί το ίδιο σε μοναδικό αναγνωριστικό για να συνδέσει την επιστροφή ενός φαρμακευτικού προϊόντος στο πλαίσιο ενός προγράμματος κοινωνικοποιημένης ιατρικής.
Οι φαρμακευτικοί παραγωγοί και οι παράλληλοι έμποροι πρέπει αναφέρετε δεδομένα σε κεντρικό κόμβο της ΕΕ διευθύνεται από το Ευρωπαϊκός Οργανισμός Επαλήθευσης Φαρμάκων (EMVO), το οποίο επίσης ενσωματώνει τους χρήστες στο Hub. Αυτό θα ωθήσει τα δεδομένα σε κατάλληλα αποθετήρια δεδομένων που διαχειρίζονται οι αντίστοιχοι Εθνικοί Οργανισμοί Επαλήθευσης Φαρμάκων (NMVO), οι οποίοι είναι υπεύθυνοι για την ενσωμάτωση του τελικού χρήστη και για τη λειτουργία των εθνικών συστημάτων.
Απαιτήσεις αναφοράς
Σύμφωνα με τον αφθώδη πυρετό της ΕΕ, ο Κάτοχος Άδειας Κυκλοφορίας (ΚΑΚ) υποχρεούται να υποβάλλει δεδομένα βασικού προϊόντος και δεδομένα σειριακής συσκευασίας προϊόντων.
Τα κύρια δεδομένα περιλαμβάνουν:
- Κωδικοί προϊόντων
- Μορφή
- Δύναμη
- Δόσεις ανά συσκευασία
- Τύπος συσκευασίας
- Αγορές-στόχοι για διανομή
- Μελλοντικές και τυχόν ενημερώσεις στα κύρια δεδομένα προϊόντος
Τα δεδομένα σειριακής συσκευασίας προϊόντων περιλαμβάνουν:
- Κωδικοί προϊόντων
- Αριθμός παρτίδας
- Ημερομηνία λήξης
- Σειριακοί αριθμοί
- Τυχόν ενημερώσεις στα δεδομένα σειριακής συσκευασίας προϊόντων
