Медициналық құрылғылар
Бақылау мүмкіндігі медициналық құрылғылар мен in vitro құрылғыларының жалпы сапасын бақылауда, қадағалауда және жақсартуда маңызды рөл атқарады.
ЕО ережелері
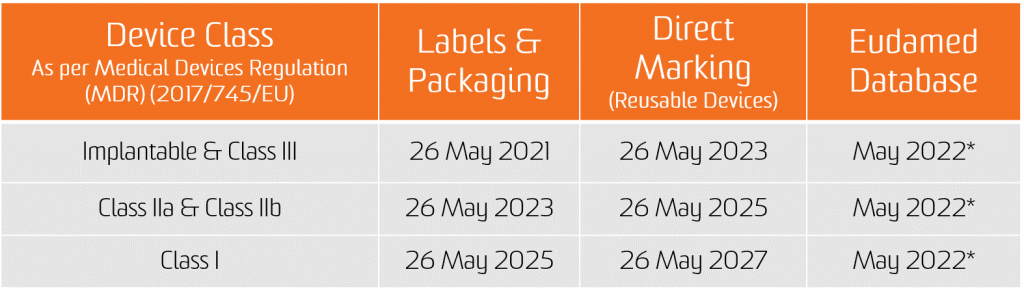
2017 жылы Медициналық құрылғыларды реттеу (MDR) жарияланды және MDD-ден AIMDD-ге өтудің төрт жылдық сапарының басталуын белгіледі. 2021 жылдың 26 мамырынан бастап MDR толығымен қолданылады. MDR медициналық құрылғыларды өндіру, тарату немесе сатып алу салаларына әсер етеді.
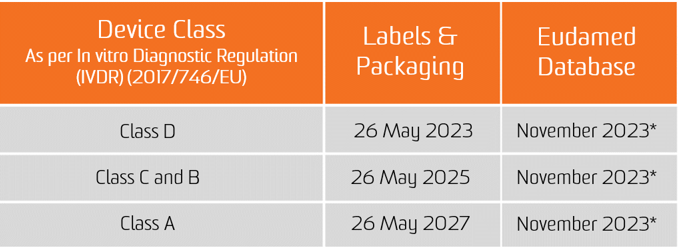
The In vitro диагностикалық ереже (IVDR) 2017 жылдың 25 мамырында күшіне енді. 2022 жылдың 26 мамырынан бастап жаңа құрылғылар Еуропа нарығында орналастыру үшін IVDR талаптарына сәйкес келуі керек. Хабарландырылған органмен сертификатталған өнімдер кейбір жағдайларда және өндіруші IVDR-де белгіленген нақты алғышарт талаптарын орындаса, 2024 жылдың 25 мамырына дейін нарыққа шығарылуы мүмкін.
UDI дегеніміз не?
UDI (Бірегей Құрылғы идентификациясы)
The UDI жаһандық деңгейде қабылданған құрылғы сәйкестендіру және кодтау стандарты арқылы жасалған сандық немесе әріптік таңбалар қатары. Ол нарықтағы белгілі бір құрылғыны бір мәнді анықтауға мүмкіндік береді. UDI UDI-DI және UDI-PI-ден тұрады.
 UDI-DI (GS1 эквивалентті GTIN – жаһандық сауда элементінің нөмірі)
UDI-DI (GS1 эквивалентті GTIN – жаһандық сауда элементінің нөмірі)
UDI-DI құрылғы үлгісіне тән бірегей сандық немесе әріптік-цифрлық код болып табылады және ол UDI дерекқорында сақталған ақпаратқа «кіру кілті» ретінде де пайдаланылады.
 UDI- PI (GS1 эквивалентті AI – қолданба идентификаторлары)
UDI- PI (GS1 эквивалентті AI – қолданба идентификаторлары)
UDI-PI - құрылғы өндірісінің бірлігін анықтайтын сандық немесе әріптік код.
UDI-PI әртүрлі түрлеріне сериялық нөмір, лот нөмірі, бағдарламалық құрал сәйкестендіру және өндіру немесе жарамдылық мерзімі немесе деректердің екі түрі де кіреді.
UDI іске асыру
UDI тағайындау бойынша міндеттеме екі жаңа Ереженің қолданылған күнінен бастап қолданылады, яғни медициналық құрылғылар үшін 2021 жылдың 26 мамыры және In Vitro диагностикалық медициналық құрылғылары үшін 2022 жылдың 26 мамыры.
EUDAMED дерекқорында UDI деректерін ұсыну міндеттемесі медициналық бұйымдар үшін 2022 жылғы 26 қарашадан бастап және in vitro диагностикалық медициналық құрылғылар үшін 2023 жылғы 26 қарашадан бастап қолданылады (егер EUDAMED тиісті Ережені қолдану күніне дейін толық жұмыс істейтін болса; әйтпесе, бұл міндеттеме EUDAMED толық жұмыс істегеннен кейін 24 айдан кейін қолданылады).
Дегенмен, өндірушілер медициналық құрылғылар үшін 2021 жылдың 26 мамырынан бастап және In Vitro диагностикалық медициналық құрылғылары үшін 2022 жылдың 26 мамырынан бастап тіркеу міндеттемелерін өз еркімен орындай алады.
Eudamed толық жұмыс істеп тұрған жағдайда, медициналық бұйымдар үшін 2021 жылдың 26 мамырынан кейін және In Vitro диагностикалық медициналық құрылғылары үшін 2022 жылдың 26 мамырынан кейін кез келген уақытта құрылғыларды толық тіркеу (MDR 29-бап және IVDR 26-бап) жүзеге асырылатынын ескеру қажет. Еудамедте олардың тиісті ауыр оқиғасын ықтимал тіркеудің алғы шарты болып қала береді.
* CAMD 2020 жылғы 11 қарашадағы шығарылымында Еуропалық Комиссия заңды себептерге байланысты Eudamed-ті іске қосуды 2022 жылдың мамырына дейін шегеретінін жариялайды. Eudamed-ті іске қосудың жаңа күні 2022 жылдың 26 мамырында күшіне енетін In Vitro диагностикалық ережесін енгізу күніне сәйкес келеді.
EUDAMED дегеніміз не?
Медициналық құрылғылар туралы жаңа нормативтік еуропалық деректер базасы
Eudamed – MDR және IVDR ережелеріне сәйкес ұлттық құзыретті органдар мен Комиссия арасында ақпарат алмасу үшін орталық репозиторий ретінде әрекет ететін қауіпсіз веб-негізделген портал.
Эудамедтің негізгі рөліне келесі міндеттер кіреді:
Eudamed тіркеу
UDI/Құрылғыларды тіркеу
Хабарландырылған органдардан сертификаттарды алыңыз және қараңыз
Клиникалық зерттеулер мен өнімділікті зерттеу деректерін қамтамасыз етіңіз
Қырағылық пен нарықтан кейінгі бақылау туралы хабарлаңыз
Нарықты қадағалау қызметі
Медициналық құрылғы ережелері бойынша барлығы бір жерде вебинарларды қараңыз
[Веб-трансляция]: GS1 және SoftGroup ұсынған медициналық құрылғыларға арналған UDI талаптарын қанағаттандыру