Общий обзор ящура ЕС
После публикации в июле 2011 года Директивы о фальсифицированных лекарственных средствах (FMD) Европейское агентство по лекарственным средствам (EMA) положить начало стандартам прослеживаемости стран в Европейском союзе.
The Директива о фальсифицированных лекарственных средствах (Директива 2011/62/ЕС) вводит гармонизированные европейские меры по борьбе с фальсификацией лекарств и обеспечению их безопасности и строгого контроля над лекарствами в торговом обороте. Меры включают:
- Обязательные элементы безопасности – уникальный идентификатор и устройство защиты от несанкционированного доступа – на внешней упаковке лекарственных средств
- Общий для всего ЕС логотип для обозначения легальных интернет-аптек.
- Ужесточены правила ввоза активных фармацевтических субстанций
- Усилены требования к ведению учета для оптовых дистрибьюторов
С 2019 года все фармацевтические продукты должны полностью соответствовать обязательствам по ящуру. До 2025 года страны ЕС с отдельной системой, такие как Греция и Италия, должны полностью соблюдать правила отслеживания фармацевтических препаратов.
Требования к сериализации
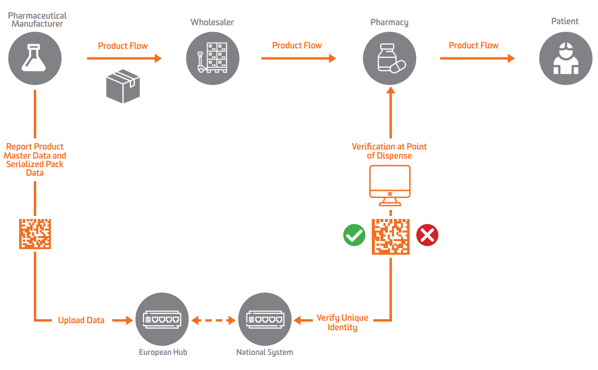
Согласно EU FMD, сериализация должна появляться на вторичном или продаваемом уровне в Европе. Чтобы включить проверку, производители должны сначала сериализовать продукт и отправить эти сериализованные данные в центральный репозиторий, который может выполнять запросы к нему.
Чтобы обеспечить сериализацию, проверку и отчетность властям, FMD ЕС требует, чтобы производители маркировали упаковки четырьмя элементами данных, которые должны быть распечатаны в удобочитаемой форме, закодированы и сохранены в GS1 2D DataMatrix:
- Идентификатор продукта
- Серийный номер
- Номер партии или партии
- Дата истечения срока действия
Использование пятого элемента данных — национального номера возмещения — не является обязательным, и лишь немногие государства ЕС могут запросить его включение в уникальный идентификатор, чтобы связать возмещение стоимости лекарственного препарата в рамках программы социализированной медицины.
Фармацевтические производители и параллельные трейдеры должны передавать данные в центральный центр ЕС управляется Европейская организация по проверке лекарственных средств (EMVO), который также подключает пользователей к Hub. Это позволит передавать данные в соответствующие репозитории данных, находящиеся в ведении соответствующих национальных организаций по проверке лекарственных средств (NMVO), которые отвечают за адаптацию конечных пользователей и за работу национальных систем.
Требования к отчетности
В рамках EU FMD держатель регистрационного удостоверения (MAH) должен предоставить основные данные о продукте и серийные данные об упаковке продукта.
Основные данные включают в себя:
- Коды продуктов
- Форма
- Сила
- Дозы в упаковке
- Тип упаковки
- Целевой рынок (ы) для распространения
- Будущие и любые обновления основных данных продукта
Серийные данные упаковки продукта включают:
- Коды продуктов
- Номер партии/партии
- Дата истечения срока действия
- Серийные номера
- Любые обновления сериализованных данных упаковки продуктов
