医疗设备
可追溯性对于医疗器械和体外器械整体质量的监测、监督和改进具有关键作用。
欧盟法规
2017年 医疗器械法规 (MDR) 出版并标志着从 MDD 到 AIMDD 的四年过渡之旅的开始。自 2021 年 5 月 26 日起,MDR 将全面适用。 MDR 影响医疗器械的制造、分销或采购行业。
这 体外诊断法规 (IVDR) 于 2017 年 5 月 25 日生效。从 2022 年 5 月 26 日起,新设备必须满足 IVDR 的要求才能投放欧洲市场。在某些条件下并且制造商满足 IVDR 中规定的特定先决条件要求的情况下,已通过公告机构认证的产品可在 2024 年 5 月 25 日之前投放市场。
什么是 UDI?
唯一标识码 (独特的 设备标识)
这 唯一标识码 是通过全球接受的设备识别和编码标准创建的一系列数字或字母数字字符。它允许明确识别市场上的特定设备。 UDI 由 UDI-DI 和 UDI-PI 组成。
 UDI-DI (GS1 等效 GTIN - 全球贸易项目编号)
UDI-DI (GS1 等效 GTIN - 全球贸易项目编号)
UDI-DI 是特定于设备型号的唯一数字或字母数字代码,也用作 UDI 数据库中存储的信息的“访问密钥”。
 UDI-PI (GS1 等效 AI – 应用程序标识符)
UDI-PI (GS1 等效 AI – 应用程序标识符)
UDI-PI 是标识器械生产单位的数字或字母数字代码。
不同类型的 UDI-PI 包括序列号、批号、软件标识和制造日期或有效期,或两种类型的数据。
UDI实施
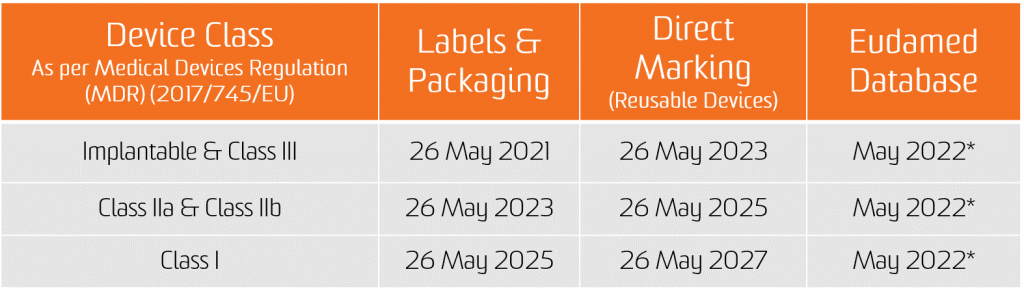
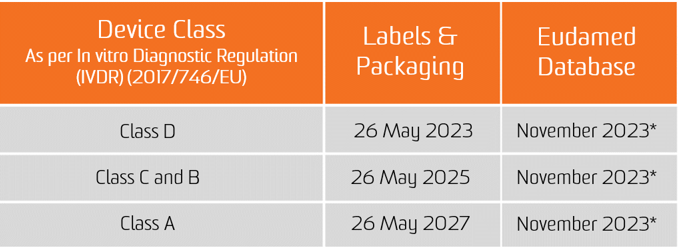
UDI 分配的义务自两项新法规的适用之日起适用,即医疗器械自 2021 年 5 月 26 日起,体外诊断医疗器械自 2022 年 5 月 26 日起适用。
在 EUDAMED 数据库中提交 UDI 数据的义务自 2022 年 11 月 26 日起适用于医疗器械,自 2023 年 11 月 26 日起适用于体外诊断医疗器械(前提是 EUDAMED 在相应法规的适用日期之前功能齐全;否则,该义务在 EUDAMED 完全发挥作用后 24 个月适用)。
但是,自 2021 年 5 月 26 日起医疗器械和 2022 年 5 月 26 日起体外诊断医疗器械,制造商将能够自愿遵守注册义务。
需要注意的是,如果 Eudamed 功能完备,医疗器械在 2021 年 5 月 26 日和体外诊断医疗器械在 2022 年 5 月 26 日之后的任何时间,设备的完整注册(MDR 第 29 条和 IVDR 第 26 条)仍然是可能在 Eudamed 中登记其相关严重事件的先决条件。
*2020 年 11 月 11 日的 CAMD 问题文件指出,欧盟委员会宣布出于法律原因将 Eudamed 的整体发布推迟到 2022 年 5 月。 Eudamed 的新发布日期与体外诊断法规的实施日期一致,该法规将于 2022 年 5 月 26 日生效。
什么是 EUDAMED?
新的欧洲医疗器械监管数据库
Eudamed 是一个安全的基于网络的门户网站,作为国家主管当局和委员会之间根据 MDR 和 IVDR 条例进行信息交换的中央存储库。
Eudamed 的主要职责包括以下职责:
Eudamed注册
UDI/设备注册
从公告机构获取和查看证书
提供临床调查和性能研究数据
报告警惕和上市后监督
市场监督活动