سنقدم في هذه المقالة بعض التوضيحات حول استخدام المعايير العالمية مقابل المعايير الوطنية لتدوين المنتجات الطبية لتنفيذ توجيهات الاتحاد الأوروبي بشأن الأدوية المزيفة (EU FMD) في فرنسا.
جدول المحتويات
خلفية
في عام 2019، اعتمدت GS1 قواعد لضمان الهوية الفريدة والنزاهة في نظام الترميز الخاص بها، خاصة عندما تقوم أطراف ثالثة بتعيين رموز.
قامت GS1 France لاحقًا بتحديث عقدها مع Club Inter Pharmaceutique (CIP) للتوافق مع هذه القواعد.
في ديسمبر 2021، قامت ANSM (الوكالة الوطنية الفرنسية لسلامة الأدوية والمنتجات الصحية)، وCIP، وGS1 France بإضفاء الطابع الرسمي على "اتفاقية ثلاثية" للحفاظ على نظام تدوين المنتجات الطبية في فرنسا لمدة ثلاث سنوات (مع احتمال تمديد لمدة عام واحد). تهدف هذه الاتفاقية، إلى جانب مرسوم وأمر ذي صلة من وزارة الصحة الفرنسية، إلى تأمين سلسلة التوريد وإمكانية التتبع والسداد ووصول المرضى إلى المنتجات الطبية في فرنسا، ودمج رموز CIP وUCD في القانون الفرنسي.
الرموز المستخدمة لتحديد المنتجات الطبية المصرح بها في السوق الفرنسية هي:
- الرقم الوطني المميز لكل عبوة ويسمى "code identifiant de présentation" (CIP code)
- وحيثما ينطبق ذلك، الرقم الذي يحدد وحدة التوزيع المشتركة (عادة، مستوى الحزمة الأولية)، المسمى "رمز تعريف وحدة التوزيع المشتركة" (رمز UCD).
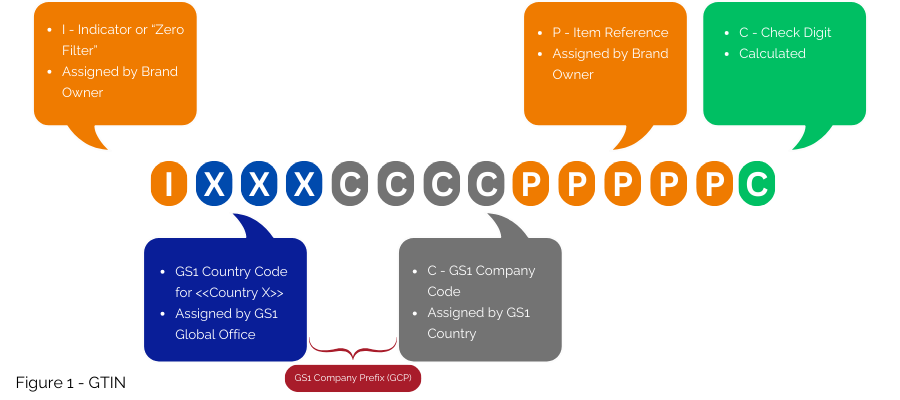
هذه هي الرموز الحالية المكونة من 13 حرفًا، والأرقام الأربعة الأولى هي البادئة 3400 التي تم تعيينها بواسطة GS1 France إلى CIP منذ عام 2006. ويتوافق هذا الرمز مع ISO/IEC 15459-3 2014 وISO/IEC 15459-4 2014، أي: معايير GS1 المعترف بها من قبل ISO.
الاعتبارات الفنية بشأن النظام العالمي مقابل الوطني لتدوين المنتجات الطبية
تشمل المقترحات الخاصة بالحل طويل المدى الذي سيتم تنفيذه في فرنسا لتدوين المنتجات الطبية ما يلي:
1. استمرار استخدام المعايير العالمية المستندة إلى معايير GS1 كالرمز المستخدم لسلسلة التوريد/الأغراض اللوجستية (أي مع الرقم الوطني المستخدم لترخيص السوق والسداد)، إما مع رقم الصنف التجاري الوطني الحالي (NTIN بدءًا من مع 3400) أو عن طريق تعيين الرقم الوطني إلى رقم البند التجاري العالمي (GTIN) كما هو مطبق في دول الاتحاد الأوروبي الأخرى.
أو
2. الانتقال إلى استخدام معيار وطني يعتمد على رمز CIP. منذ مايو 2023، أصبح CIP معتمدًا آيزو/آي إي سي 15459 وكالة الإصدار ويمكنها إنشاء معرفات فريدة تبدأ بالبادئة VIP.
الاستمرار في استخدام المعايير العالمية المبنية على معايير GS1
الخيار الأول
بالنسبة لدول مثل فرنسا التي لديها أنظمة ترقيم وطنية حالية، توفر GS1 استراتيجيات للانتقال إلى الترقيم المنسق عالميًا. يقترح GS1 استخدام GTIN (الشكل 1) لتنفيذ نظام الاتحاد الأوروبي لمكافحة الحمى القلاعية، وترميزه بشكل أساسي في GS1 DataMatrix. إذا كان لا بد من الاحتفاظ بالرقم الوطني، فيمكن استرجاعه عبر مرجع مرجعي لقاعدة البيانات، دون تضمينه في GS1 DataMatrix.
ومع ذلك، تدرك GS1 أنه في بعض الدول الأعضاء، نظرًا لمتطلبات إدارة نظام الرعاية الصحية أو الحاجة إلى الانتقال إلى المعايير العالمية، قد يلزم عرض الرقم الوطني على العبوة بتنسيق يمكن قراءته بواسطة الإنسان، وليس بالضرورة مشفرًا في الرمز الشريطي.
يتضمن الاقتراح تعيين رمز CIP إلى رقم GTIN باستخدام جدول التحويل، كما هو موضح في بلجيكا، وتسهيل استخدامه داخل نظام GS1. إذا لزم الأمر، يمكن طباعة رمز CIP بتنسيق يمكن قراءته بواسطة الإنسان على العبوة، دون تشفيره في الرمز الشريطي، كما هو الحال في إسبانيا اليوم.
الخيار الثاني
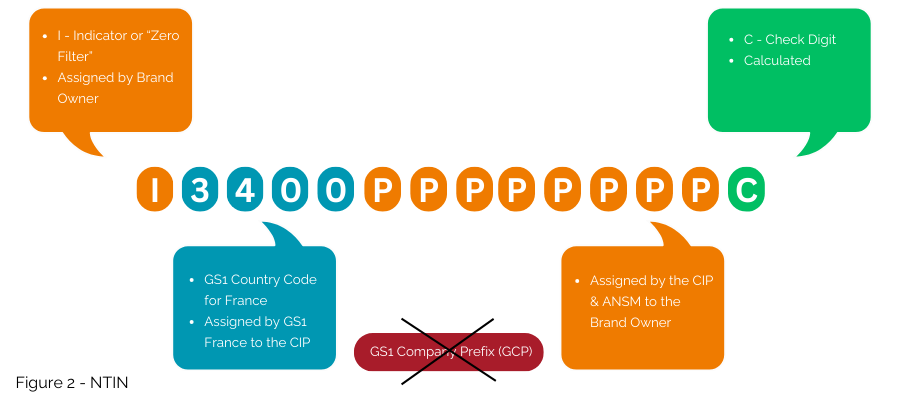
الخيار الثاني، الذي لا يزال متوافقًا مع نظام GS1 حتى لو لم يكن الأكثر قابلية للتشغيل البيني عالميًا، هو تضمين الرقم الوطني في NTIN، بدلاً من استخدام GTIN.
هذا هو الحل المطبق حاليًا بموجب العقد المبرم بين GS1 France وCIP وANSM. تم ترخيص بادئة GS1 3400 بواسطة GS1 France لـ CIP للسماح بتضمين الرقم الصادر عن CIP وANSM في بنية GTIN كرقم NTIN (الشكل 2)؛ ومن ثم يتيح استخدامه داخل نظام GS1.
الانتقال إلى استخدام معيار وطني يعتمد على رمز CIP
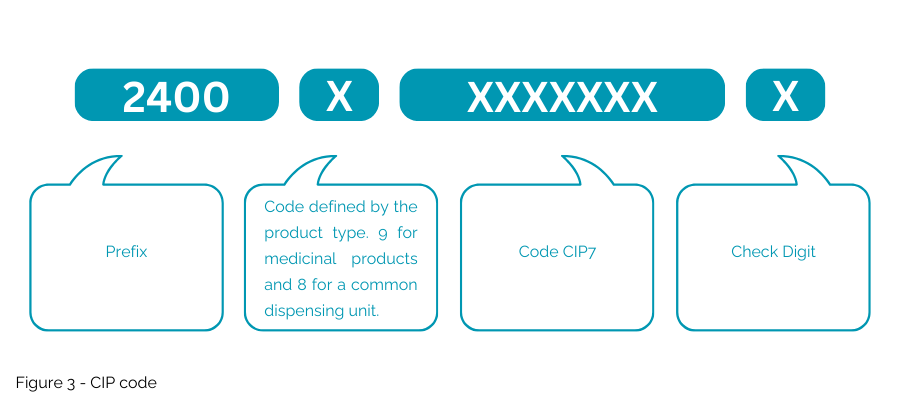
يختلف رمز CIP (الشكل 3) المقترح عن NTIN الحالي المستخدم في السوق الفرنسية حيث لن يتم تضمين "رمز CIP" المقترح في مفتاح GS1. لن يتم قبول هذا الرمز الوطني إلا في فرنسا للاستخدام المحدد ولن يسمح باستخدام العبوات متعددة الأسواق.
الاختلافات بين رمز CIP وNTIN
فيما يلي مقارنة بين تشفير معرفات GS1 وترميز رمز CIP المقترح
1. ترميز معرفات GS1
- يستخدم حرفًا واحدًا للوظيفة الرئيسية للدلالة على استخدام GS1 DataMatrix، واستدعاء قواعد فك تشفير GS1.
- قم بتضمين AI (01) في بداية NTIN للإشارة إلى أن الأحرف التالية تمثل GTIN أو NTIN (رمز المنتج).
- قم بدمج الذكاء الاصطناعي (17) في بداية تاريخ انتهاء الصلاحية، للإشارة إلى أن الأحرف التالية تمثل تاريخ انتهاء الصلاحية.
- استخدم الذكاء الاصطناعي (10) في بداية رقم الدُفعة/الدفعة، للإشارة إلى أن الأحرف التالية تمثل رقم الدُفعة/الدفعة.
- استخدم AI (21) في بداية الرقم التسلسلي، للإشارة إلى أن الأحرف التالية تمثل رقمًا تسلسليًا.
2. ترميز كود CIP المقترح
- سيتم ترميزها في مصفوفة بيانات ISO/IEC عامة، مما يستلزم نظامًا جديدًا ومحددًا لإدارة البيانات.
- استخدم "1P" كمحدد للبيانات في البداية للإشارة إلى رمز CIP (رمز المنتج)؛ "AI" حصري لبناء جملة GS1.
- قم بدمج "9D" كمحدد للبيانات في البداية لتاريخ انتهاء الصلاحية.
- استخدم "1T" كمحدد للبيانات في البداية لرقم الدفعة/الدفعة.
- قم بتضمين "S" كمحدد للبيانات في بداية الرقم التسلسلي.
الاستنتاج - التأثير المحتمل لتنفيذ التدوين الجديد للمنتجات الطبية
ستحتاج ملصقات المنتجات الطبية الموردة إلى فرنسا إلى المراجعة لتتمكن من حمل مصفوفة بيانات ISO العامة (الشكل 4) التي ترمز لرمز CIP وسمات البيانات الأخرى. وسيستمر استخدام GS1 DataMatrix في دول الاتحاد الأوروبي الأخرى (الشكل 5).
(صورة من ورقة مناقشة حول استخدام المعايير العالمية مقابل المعايير الوطنية لتكثيف المنتجات الطبية لتنفيذ توجيهات الاتحاد الأوروبي بشأن الأدوية المزيفة في فرنسا)
تطرح التغييرات المقترحة في تشفير بيانات المنتجات الطبية، وتحديدًا التحول من معايير GS1 إلى نظام ترميز وطني فريد في فرنسا، تحديات كبيرة. لن تكون أنظمة المسح وفك التشفير والمعالجة الحالية قادرة على تفسير البيانات تلقائيًا داخل مصفوفة البيانات الجديدة دون ترقيات مخصصة. لا يؤثر هذا التغيير على الشركات المصنعة فحسب، بل يمكن أن يسبب أيضًا اضطرابًا في سلسلة التوريد بأكملها، مما يؤثر على المستشفيات والصيدليات التي تأخرت بالفعل في تنفيذ قانون الاتحاد الأوروبي لمكافحة الحمى القلاعية.
وهذا من شأنه أن يقوض إمكانية التشغيل البيني داخل النظام الفرنسي وبين النظام الفرنسي وأنظمة الاتحاد الأوروبي الأخرى، فضلا عن أن يشكل تهديدا للوصول إلى المنتجات الطبية في فرنسا والقدرة التنافسية للصناعة المحلية.
مصدر: جي أس 1 | ورقة مناقشة حول استخدام المعايير العالمية مقابل المعايير الوطنية لتدوين المنتجات الطبية لتنفيذ توجيهات الاتحاد الأوروبي بشأن الأدوية المزيفة في فرنسا