[Blog] Änderungen in der Kodifizierung von Arzneimitteln in Frankreich
In diesem Artikel werden wir einige Erläuterungen zur Verwendung globaler und nationaler Standards für die Kodifizierung von Arzneimitteln geben, um die EU-Fälschungsrichtlinie (EU FMD) in Frankreich umzusetzen.
Inhaltsverzeichnis
Hintergrund
Im Jahr 2019 hat GS1 Regeln zur Gewährleistung der eindeutigen Identifizierung und Integrität in seinem Kodifizierungssystem eingeführt, insbesondere bei der Vergabe von Codes durch Dritte.
Anschließend hat GS1 France seinen Vertrag mit dem Club Inter Pharmaceutique (CIP) aktualisiert, um ihn an diese Regeln anzupassen.
Im Dezember 2021 haben ANSM (Französische Nationale Agentur für die Sicherheit von Arzneimitteln und Gesundheitsprodukten), CIP und GS1 France eine „dreiseitige Vereinbarung“ formalisiert, um das französische Arzneimittelkodifizierungssystem für drei Jahre (mit einer möglichen Verlängerung um ein Jahr) aufrechtzuerhalten. Ziel dieser Vereinbarung und eines entsprechenden Erlasses und einer Anordnung des französischen Gesundheitsministeriums ist es, die Lieferkette, die Rückverfolgbarkeit, die Erstattung und den Patientenzugang zu Arzneimitteln in Frankreich zu sichern und die CIP- und UCD-Codes in französisches Recht zu integrieren.
Die Codes zur Identifizierung von auf dem französischen Markt zugelassenen Arzneimitteln sind:
- die nationale Nummer zur Identifizierung jeder Verpackung, genannt „code identifiant de présentation“ (CIP-Code)
- und gegebenenfalls die Nummer zur Identifizierung der gemeinsamen Abgabeeinheit (normalerweise die primäre Verpackungsebene), die als „Code identifiant l'unité commune de dispensation“ (UCD-Code) bezeichnet wird.
Dies sind die aktuellen 13-stelligen Codes, wobei die ersten 4 Ziffern das Präfix 3400 sind, das GS1 France dem CIP seit 2006 zugewiesen hat. Dieser Code entspricht ISO/IEC 15459-3 2014 und ISO/IEC 15459-4 2014, d. h. Von der ISO anerkannte GS1-Standards.
Technische Überlegungen zu einem globalen vs. nationalen System zur Kodifizierung von Arzneimitteln
Zu den Vorschlägen für die in Frankreich umzusetzende langfristige Lösung zur Kodifizierung von Arzneimitteln gehören:
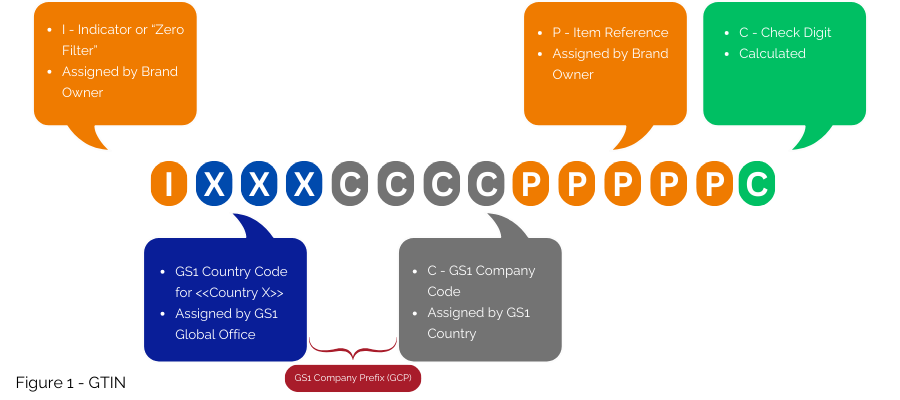
1. die Fortführung der Verwendung globaler Standards auf der Grundlage der GS1-Standards als Code für Lieferketten-/Logistikzwecke (d. h. mit der nationalen Nummer, die für die Marktzulassung und Erstattung verwendet wird), entweder mit der aktuellen National Trade Item Number (ab NTIN). mit 3400) oder durch Zuordnung der nationalen Nummer zu einer Global Trade Item Number (GTIN), wie es in anderen EU-Ländern implementiert ist.
Oder
2. der Übergang zur Verwendung eines nationalen Standards basierend auf dem CIP-Code. Seit Mai 2023 ist das CIP zugelassen ISO/IEC 15459 ausstellende Behörde und kann eindeutige Identifikatoren generieren, die mit dem Präfix VIP beginnen.
Fortsetzung der Nutzung globaler Standards auf Basis der GS1-Standards
Erste Wahl
Für Länder wie Frankreich mit bestehenden nationalen Nummerierungssystemen bietet GS1 Strategien für den Übergang zu einer weltweit harmonisierten Nummerierung. GS1 schlägt vor, die GTIN (Abbildung 1) zur Umsetzung der EU-FMD zu verwenden und diese hauptsächlich in der GS1 DataMatrix zu kodieren. Wenn eine nationale Nummer beibehalten werden muss, kann diese über einen Datenbankquerverweis abgerufen werden, ohne sie in die GS1 DataMatrix aufzunehmen.
GS1 erkennt jedoch an, dass in einigen Mitgliedsstaaten aufgrund von Verwaltungsanforderungen des Gesundheitssystems oder der Notwendigkeit des Übergangs zu globalen Standards die nationale Nummer möglicherweise in einem für Menschen lesbaren Format auf der Verpackung angezeigt werden muss und nicht unbedingt im Barcode kodiert sein muss.
Der Vorschlag beinhaltet die Zuordnung des CIP-Codes zu einer GTIN mithilfe einer Konvertierungstabelle, wie in Belgien demonstriert, und die Erleichterung seiner Verwendung im GS1-System. Bei Bedarf kann der CIP-Code in einem für Menschen lesbaren Format auf die Verpackung gedruckt werden, ohne ihn im Barcode zu kodieren, wie es heute in Spanien geschieht.
Zweite Option
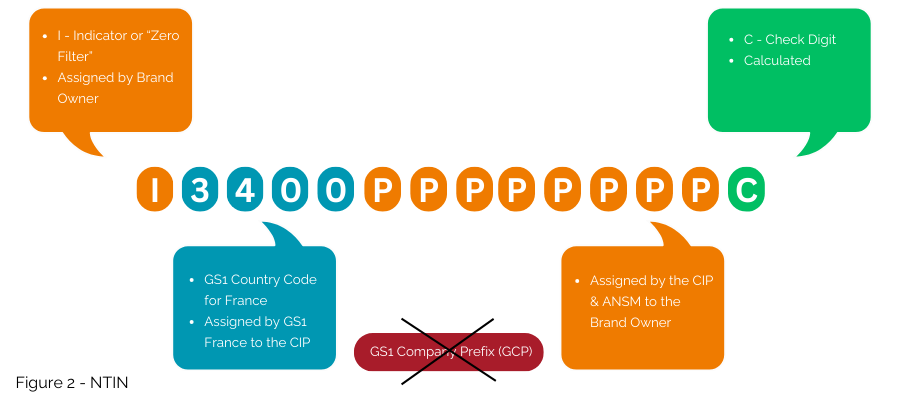
Die zweite Option, die immer noch mit dem GS1-System kompatibel ist, wenn auch nicht die weltweit interoperabelste, besteht darin, die nationale Nummer in eine NTIN einzubetten, anstatt eine GTIN zu verwenden.
Dies ist die Lösung, die derzeit im Rahmen des Vertrags zwischen GS1 France, dem CIP und dem ANSM umgesetzt wird. Das GS1-Präfix 3400 wird von GS1 France an das CIP lizenziert, um die Einbettung der von CIP und ANSM vergebenen Nummer als NTIN in die GTIN-Struktur zu ermöglichen (Abbildung 2); es ermöglicht dann die Nutzung innerhalb des GS1-Systems.
Übergang zur Verwendung eines nationalen Standards basierend auf dem CIP-Code
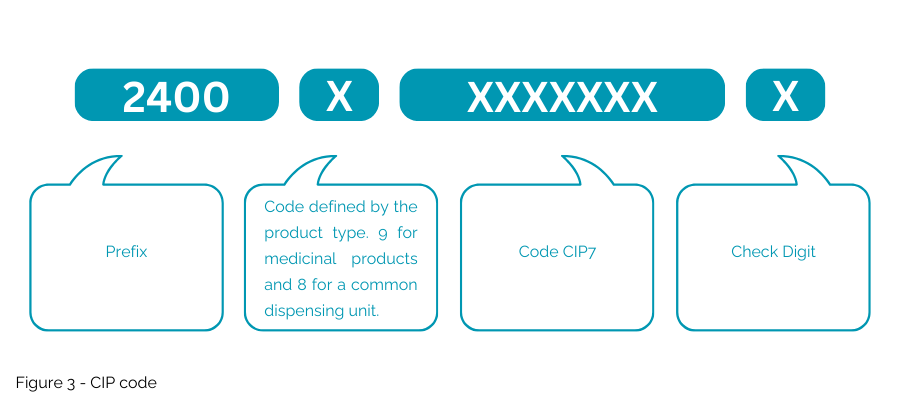
Der vorgeschlagene CIP-Code (Abbildung 3) unterscheidet sich von der derzeit für den französischen Markt verwendeten NTIN, da der vorgeschlagene „CIP-Code“ nicht in einen GS1-Schlüssel eingebettet würde. Dieser nationale Code wird in Frankreich nur für eine bestimmte Verwendung akzeptiert und erlaubt nicht die Verwendung von Multimarket-Verpackungen.
Unterschiede zwischen CIP-Code und NTIN
Hier ist ein Vergleich zwischen der Kodierung von GS1-Kennungen und der Kodierung des vorgeschlagenen CIP-Codes
1.Kodierung von GS1-Kennungen
- Verwendet ein führendes Function One-Zeichen, um die Verwendung von GS1 DataMatrix anzuzeigen und GS1-Dekodierungsregeln aufzurufen.
- Fügen Sie AI (01) am Anfang der NTIN ein, um anzugeben, dass die folgenden Zeichen eine GTIN oder NTIN (Produktcode) darstellen.
- Fügen Sie AI (17) am Anfang des Ablaufdatums ein, um anzuzeigen, dass die folgenden Zeichen ein Ablaufdatum darstellen.
- Verwenden Sie AI (10) am Anfang der Chargen-/Losnummer, um anzuzeigen, dass die folgenden Zeichen eine Chargen-/Losnummer darstellen.
- Verwenden Sie AI (21) am Anfang der Seriennummer, was bedeutet, dass die folgenden Zeichen eine Seriennummer darstellen.
2. Kodierung des vorgeschlagenen CIP-Codes
- Wird in eine generische ISO/IEC-Datenmatrix kodiert, was ein neues, spezifisches Datenverwaltungssystem erfordert.
- Verwenden Sie am Anfang „1P“ als Datentrennzeichen, um einen CIP-Code (Produktcode) anzugeben. „AI“ ist exklusiv für die GS1-Syntax.
- Fügen Sie am Anfang „9D“ als Datentrennzeichen für das Ablaufdatum ein.
- Verwenden Sie „1T“ als Datentrennzeichen am Anfang für die Chargen-/Losnummer.
- Fügen Sie „S“ als Datentrennzeichen am Anfang der Seriennummer ein.
Fazit – Mögliche Auswirkungen der Umsetzung einer neuen Kodifizierung von Arzneimitteln
Die Etiketten und Verpackungen der nach Frankreich gelieferten Arzneimittel müssen überarbeitet werden, um die generische ISO-Datenmatrix (Abbildung 4) zu tragen, die den CIP-Code und andere Datenattribute kodiert. Die GS1 DataMatrix wird weiterhin in anderen EU-Ländern eingesetzt (Abbildung 5).
(Bild aus dem Diskussionspapier über die Verwendung globaler vs. nationaler Standards für die Zulassung von Arzneimitteln zur Umsetzung der EU-Fälschungsrichtlinie in Frankreich)
Die vorgeschlagenen Änderungen bei der Kodierung von Arzneimitteldaten, insbesondere die Umstellung von GS1-Standards auf ein einzigartiges nationales Kodierungssystem in Frankreich, stellen erhebliche Herausforderungen dar. Bestehende Scan-, Dekodierungs- und Verarbeitungssysteme werden ohne benutzerdefinierte Upgrades nicht in der Lage sein, Daten innerhalb der neuen Data Matrix automatisch zu interpretieren. Diese Änderung betrifft nicht nur die Hersteller, sondern könnte auch zu Turbulenzen in der gesamten Lieferkette führen und sich auf Krankenhäuser und Apotheken auswirken, die bei der Umsetzung der EU-FMD bereits im Rückstand sind.
Dies würde die Interoperabilität innerhalb des französischen Systems und zwischen dem französischen System und den anderen EU-Systemen untergraben und eine Bedrohung für den Zugang zu Arzneimitteln in Frankreich und die Wettbewerbsfähigkeit der lokalen Industrie darstellen.
Quelle: GS1 | Diskussionspapier zur Verwendung globaler vs. nationaler Standards für die Kodifizierung von Arzneimitteln zur Umsetzung der EU-Fälschungsschutzrichtlinie in Frankreich