Dans cet article, nous apporterons quelques éclaircissements sur l'utilisation de normes mondiales ou nationales pour la codification des médicaments afin de mettre en œuvre la directive européenne sur les médicaments falsifiés (EU FMD) en France.
Table des matières
Arrière-plan
En 2019, GS1 a adopté des règles pour garantir une identification unique et l'intégrité de son système de codification, notamment lorsque des tiers attribuent des codes.
GS1 France a ensuite mis à jour son contrat avec le Club Inter Pharmaceutique (CIP) pour s'aligner sur ces règles.
En décembre 2021, l'ANSM (Agence nationale de sécurité du médicament et des produits de santé), la CIP et GS1 France ont formalisé un « accord tripartite » pour maintenir le système français de codification des médicaments pendant trois ans (avec une extension potentielle d'un an). Cet accord, ainsi qu'un décret et un arrêté du ministère de la Santé y afférent, visent à sécuriser la chaîne d'approvisionnement, la traçabilité, le remboursement et l'accès des patients aux médicaments en France, en intégrant les codes CIP et UCD dans la loi française.
Les codes utilisés pour identifier les médicaments autorisés sur le marché français sont :
- le numéro national identifiant chaque emballage appelé « code identifiant de présentation » (code CIP)
- et, le cas échéant, le numéro identifiant l'unité commune de dispensation (généralement le niveau du conditionnement primaire), appelé « code identifiant l'unité commune de dispensation » (code UCD).
Il s'agit des codes actuels à 13 caractères, les 4 premiers chiffres étant le préfixe 3400 attribué par GS1 France au CIP depuis 2006. Ce code est conforme aux normes ISO/IEC 15459-3 2014 et ISO/IEC 15459-4 2014, soit : Normes GS1 reconnues par l'ISO.
Considérations techniques sur un système mondial ou national de codification des médicaments
Les propositions de solution à long terme à mettre en œuvre en France pour la codification des médicaments comprennent :
1. la poursuite de l'utilisation de normes mondiales basées sur les normes GS1 comme code utilisé à des fins de chaîne d'approvisionnement/logistique (c'est-à-dire avec le numéro national utilisé pour l'autorisation de mise sur le marché et pour le remboursement), soit avec le numéro d'article commercial national actuel (NTIN commençant avec 3400) ou en mappant le numéro national sur un numéro d'article commercial mondial (GTIN), comme cela est mis en œuvre dans d'autres pays de l'UE.
Ou
2. la transition vers l'utilisation d'une norme nationale basée sur le code CIP. Depuis mai 2023, le CIP est agréé ISO/CEI 15459 agence émettrice et peut générer des identifiants uniques commençant par le préfixe VIP.
Poursuite de l'utilisation de normes mondiales basées sur les normes GS1
Première option
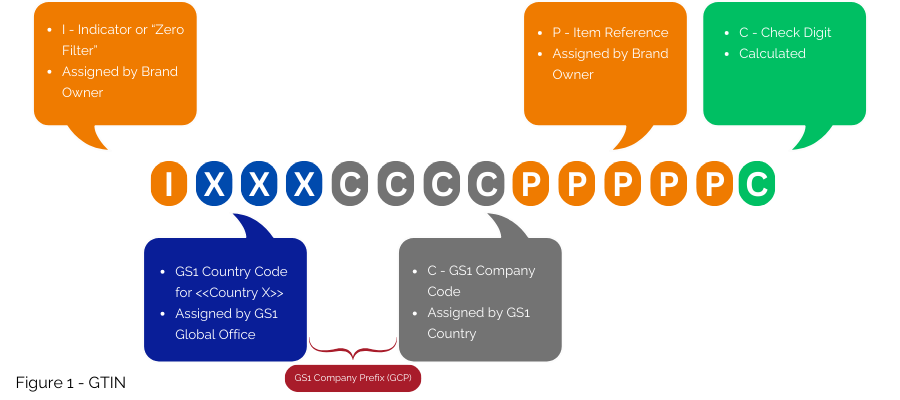
Pour les pays comme la France disposant de systèmes de numérotation nationaux existants, GS1 propose des stratégies de transition vers une numérotation harmonisée à l’échelle mondiale. GS1 suggère d'utiliser le GTIN (Figure 1) pour mettre en œuvre l'EU FMD, en l'encodant principalement dans GS1 DataMatrix. Si un numéro national doit être conservé, il peut être récupéré via une référence croisée dans la base de données, sans l'inclure dans le GS1 DataMatrix.
Cependant, GS1 reconnaît que dans certains États membres, en raison des exigences de gestion du système de santé ou de la nécessité de passer à des normes mondiales, le numéro national peut devoir être affiché sur l'emballage dans un format lisible par l'homme, pas nécessairement codé dans le code-barres.
La proposition consiste à mapper le code CIP sur un GTIN à l'aide d'une table de conversion, comme cela a été démontré en Belgique, et à faciliter son utilisation au sein du système GS1. Si nécessaire, le code CIP peut être imprimé dans un format lisible par l'homme sur l'emballage, sans l'encoder dans le code-barres, comme cela se fait aujourd'hui en Espagne.
Deuxième option
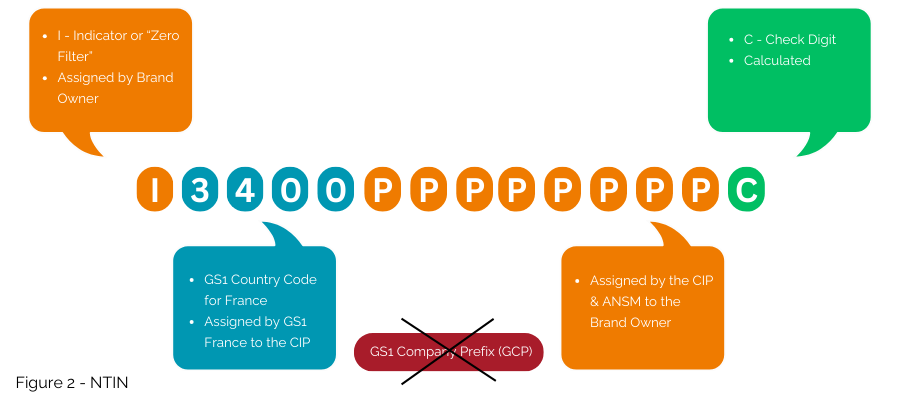
La deuxième option, toujours compatible avec le système GS1 même si elle n'est pas la plus interopérable à l'échelle mondiale, consiste à intégrer le numéro national dans un NTIN, au lieu d'utiliser un GTIN.
C'est la solution actuellement mise en œuvre dans le cadre du contrat entre GS1 France, le CIP et l'ANSM. Le préfixe GS1 3400 est concédé sous licence par GS1 France au CIP pour permettre d'intégrer le numéro émis par le CIP et l'ANSM dans la structure GTIN en tant que NTIN (Figure 2) ; il permet ensuite son utilisation au sein du système GS1.
Transition vers l'utilisation d'une norme nationale basée sur le code CIP
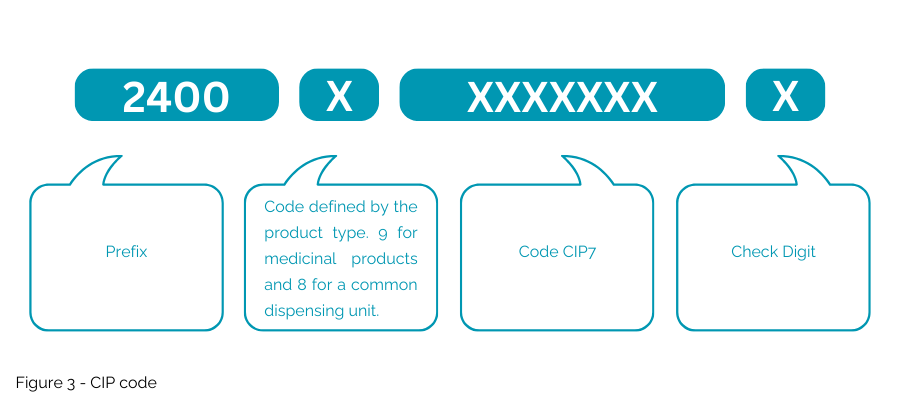
Le code CIP (Figure 3) proposé est différent du NTIN actuel utilisé pour le marché français dans la mesure où le « code CIP » proposé ne serait pas intégré dans une clé GS1. Ce code national ne sera accepté en France que pour un usage spécifique et ne permettra pas l'utilisation d'emballages multimarchés.
Différences entre le code CIP et le NTIN
Voici une comparaison entre l'encodage des identifiants GS1 et l'encodage du code CIP proposé
1.Encodage des identifiants GS1
- Utilise un caractère de début Function One pour signifier l'utilisation de GS1 DataMatrix, invoquant les règles de décodage GS1.
- Incluez AI (01) au début du NTIN pour indiquer que les caractères suivants représentent un GTIN ou un NTIN (code produit).
- Incorporez AI (17) au début de la date d'expiration, indiquant que les caractères suivants représentent une date d'expiration.
- Utilisez AI (10) au début du numéro de lot/lot, en indiquant que les caractères suivants représentent un numéro de lot/lot.
- Utilisez AI (21) au début du numéro de série, ce qui signifie que les caractères suivants représentent un numéro de série.
2. Codage du code CIP proposé
- Sera codé dans une matrice de données ISO/IEC générique, nécessitant un nouveau système de gestion de données spécifique.
- Utilisez « 1P » comme délimiteur de données au début pour indiquer un code CIP (code produit) ; « AI » est exclusif à la syntaxe GS1.
- Incorporez «9D» comme délimiteur de données au début de la date d'expiration.
- Utilisez « 1T » comme délimiteur de données au début pour le numéro de lot/lot.
- Incluez « S » comme délimiteur de données au début du numéro de série.
Conclusion – Impact potentiel de la mise en œuvre d’une nouvelle codification des médicaments
Les étiquettes et les emballages des médicaments fournis à la France devront être révisés afin de porter le Data Matrix générique ISO (Figure 4) codant le code CIP et d'autres attributs de données. Le GS1 DataMatrix continuera à être utilisé dans d’autres pays de l’UE (Figure 5).
(Image tirée du document de discussion sur l'utilisation de normes mondiales ou nationales pour la condification des médicaments afin de mettre en œuvre la directive européenne sur les médicaments falsifiés en France)
Les évolutions proposées dans la codification des données pharmaceutiques, notamment le passage des normes GS1 à une codification nationale unique en France, posent des défis importants. Les systèmes de numérisation, de décodage et de traitement existants seront incapables d'interpréter automatiquement les données du nouveau Data Matrix sans mises à niveau personnalisées. Ce changement affecte non seulement les fabricants, mais pourrait également provoquer des turbulences dans l’ensemble de la chaîne d’approvisionnement, impactant les hôpitaux et les pharmacies qui tardent déjà à mettre en œuvre l’EU FMD.
Cela porterait atteinte à l'interopérabilité au sein du système français et entre le système français et les autres systèmes de l'UE, et constituerait une menace pour l'accès aux médicaments en France et la compétitivité de l'industrie locale.
Source: GS1 | Document de discussion sur l'utilisation de normes mondiales ou nationales pour la codification des médicaments afin de mettre en œuvre la directive européenne sur les médicaments falsifiés en France