Allgemeiner Überblick über die EU FMD
Mit der im Juli 2011 veröffentlichten Falsified Medicines Directive (FMD) wurde die Europäische Arzneimittel-Agentur (EMA) setzen den Beginn der Rückverfolgbarkeitsstandards der Länder der Europäischen Union.
Der Fälschungsrichtlinie (Richtlinie 2011/62/EU) führt harmonisierte europäische Maßnahmen ein, um Arzneimittelfälschungen zu bekämpfen und sicherzustellen, dass Arzneimittel sicher sind und Arzneimittel im Handelsverkehr streng kontrolliert werden. Zu den Maßnahmen gehören:
- Obligatorische Sicherheitsmerkmale – ein eindeutiges Erkennungszeichen und ein Manipulationsschutz – auf der äußeren Verpackung von Arzneimitteln
- Ein gemeinsames, EU-weites Logo zur Kennzeichnung legaler Online-Apotheken
- Strengere Regeln für die Einfuhr von pharmazeutischen Wirkstoffen
- Verschärfte Aufzeichnungspflichten für Großhändler
Ab 2019 müssen alle pharmazeutischen Produkte die FMD-Verpflichtungen vollständig erfüllen. Bis 2025 müssen EU-Länder mit einem separaten System wie Griechenland und Italien die Arzneimittel-Track-and-Trace-Verordnung vollständig einhalten.
Serialisierungsanforderungen
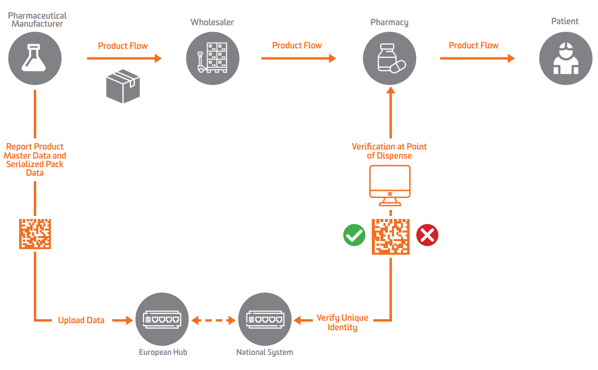
Laut EU FMD muss die Serialisierung in Europa auf der Ebene der sekundären oder verkaufsfähigen Einheit erscheinen. Um die Verifizierung zu ermöglichen, müssen Hersteller zuerst das Produkt serialisieren und diese serialisierten Daten an ein zentrales Repository senden, das Abfragen durchführen kann.
Um die Serialisierung, Verifizierung und Berichterstattung an Behörden zu ermöglichen, verlangt die EU-FMD, dass Hersteller Verpackungen mit vier Datenelementen kennzeichnen, die in für Menschen lesbarer Form gedruckt und in einer GS1-2D-DataMatrix codiert und gespeichert werden müssen:
- Produktidentifikator
- Seriennummer
- Chargen- oder Chargennummer
- Verfallsdatum
Die Verwendung des fünften Datenelements – der nationalen Erstattungsnummer – ist optional, und einige Staaten in der EU können die Aufnahme dieser Nummer in die eindeutige Kennung verlangen, um die Erstattung eines Arzneimittels im Rahmen eines staatlichen Gesundheitsprogramms zu verknüpfen.
Pharmahersteller und Parallelhändler müssen Daten an einen zentralen EU-Hub melden geführt von der Europäische Arzneimittelverifizierungsorganisation (EMVO), die auch Benutzer in den Hub einbindet. Dadurch werden die Daten an geeignete Datenspeicher weitergeleitet, die von den entsprechenden nationalen Arzneimittelverifizierungsorganisationen (NMVOs) betrieben werden, die für das Onboarding der Endbenutzer und den Betrieb der nationalen Systeme verantwortlich sind.
Meldepflichten
Gemäß der EU FMD muss der Zulassungsinhaber (MAH) Produktstammdaten und serialisierte Produktpackungsdaten einreichen.
Zu den Stammdaten gehören:
- Produktcodes
- Form
- Stärke
- Dosen pro Packung
- Packungstyp
- Zielmärkte für den Vertrieb
- Zukünftige und alle Aktualisierungen der Produktstammdaten
Serialisierte Produktpaketdaten umfassen:
- Produktcodes
- Los-/Chargennummer
- Verfallsdatum
- Seriennummer
- Alle Aktualisierungen der serialisierten Produktpaketdaten
