Algemeen overzicht van MKZ in de EU
Met de Falsified Medicines Directive (FMD) gepubliceerd in juli 2011, de Europees Geneesmiddelenbureau (EMA) het begin van de traceerbaarheidsnormen van de landen in de Europese Unie.
De Richtlijn vervalste geneesmiddelen (Richtlijn 2011/62/EU) introduceert geharmoniseerde Europese maatregelen om vervalsingen van medicijnen te bestrijden en ervoor te zorgen dat medicijnen veilig zijn en dat medicijnen in het handelsverkeer streng worden gecontroleerd. Maatregelen omvatten:
- Verplichte veiligheidskenmerken – een uniek identificatiemiddel en een anti-knoeisysteem – op de buitenverpakking van geneesmiddelen
- Een gemeenschappelijk, EU-breed logo om legale online apotheken te identificeren
- Strengere regels voor de invoer van actieve farmaceutische ingrediënten
- Strengere registratievereisten voor groothandelsdistributeurs
Vanaf 2019 moeten alle farmaceutische producten volledig voldoen aan de MKZ-verplichtingen. Tot 2025 moeten EU-landen met een apart systeem zoals Griekenland en Italië volledig voldoen aan de farmaceutische track en trace regelgeving.
Vereisten voor serialisatie
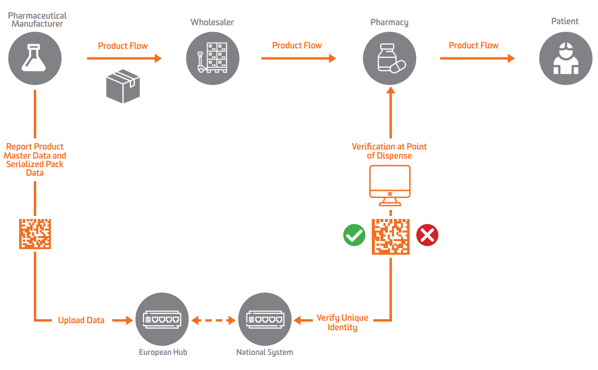
Volgens de EU FMD moet serialisatie op het niveau van de secundaire of verkoopbare eenheid in Europa voorkomen. Om verificatie mogelijk te maken, moeten fabrikanten eerst het product serialiseren en die geserialiseerde gegevens naar een centrale opslagplaats sturen die er query's op kan uitvoeren.
Om serialisatie, verificatie en rapportage aan de autoriteiten mogelijk te maken, vereist de EU FMD dat fabrikanten pakketten markeren met vier data-elementen die in voor mensen leesbare vorm moeten worden afgedrukt en gecodeerd en opgeslagen in een GS1 2D DataMatrix:
- Product-ID
- Serienummer
- Lot- of batchnummer
- Vervaldatum
Het gebruik van het vijfde gegevenselement – het nationale terugbetalingsnummer – is optioneel, en weinig staten in de EU kunnen verzoeken om dit op te nemen in de unieke identificatiecode om de terugbetaling van een geneesmiddel in het kader van een gesocialiseerd geneeskundeprogramma te koppelen.
Geneesmiddelenfabrikanten en parallelhandelaren moeten gegevens rapporteren aan een centrale EU-hub gerund door de Europese Geneesmiddelen Verificatie Organisatie (EMVO), die ook gebruikers aan boord van de Hub. Hierdoor worden gegevens naar geschikte gegevensopslagplaatsen gestuurd die worden beheerd door overeenkomstige nationale organisaties voor geneesmiddelenverificatie (NMVO's), die verantwoordelijk zijn voor de onboarding van eindgebruikers en voor de werking van de nationale systemen.
Rapportage vereisten
Onder EU FMD is de houder van de vergunning voor het in de handel brengen (MAH) verplicht om productstamgegevens en geserialiseerde productpakketgegevens in te dienen.
Stamgegevens omvatten:
- Productcodes
- Formulier
- Kracht
- Doseringen per verpakking
- Type pakket
- Doelmarkt(en) voor distributie
- Toekomstige en eventuele updates van productstamgegevens
Geserialiseerde productpakketgegevens omvatten:
- Productcodes
- Lot/batchnummer
- Vervaldatum
- Serienummers
- Alle updates van geserialiseerde productpakketgegevens
